摘要:文章为某网络整理而成,主要讲述上海奉贤废水处理厂家-如何提升活性污泥脱水性能,污水厂剩余污泥的处置日益成为一个重要的环境问题, 其处置费用约占污水处理厂总费用的60%.受限于填埋场地日趋匮乏及焚烧处......
关键词:污泥,废水处理,上海奉贤废水处理厂家.
上海奉贤废水处理厂家为您整理热点:如何提升活性污泥脱水性能。
污水厂剩余污泥的处置日益成为一个重要的环境问题, 其处置费用约占污水处理厂总费用的60%.受限于填埋场地日趋匮乏及焚烧处理利用价值低的问题, 污泥减量受到了普遍关注.提高污泥脱水性能是污泥减量的重要手段, 其常用的方法有物理法和化学法.物理法通过外加能量或作用力对污泥进行调理, 存在处理成本高的问题;而化学法需要投加大量药剂因此存在二次污染问题.近年来, 生物法被用于提升污泥脱水性能, 比如生物沥浸法, 但该方法需要投入大量的微生物营养盐, 成本较高.因此, 探索新型的生物法来提高污泥脱水性能具有重要意义.
剩余污泥中的胞外聚合物(EPS)对污泥脱水有重要影响, 过多的EPS增加了污泥中结合水的含量从而导致污泥脱水性差.因此, 降低EPS含量成为提升污泥脱水性的一个新方向.某些真菌具有生物转化活性污泥及降解EPS的能力, 从而能提升污泥的脱水性, 如毛霉属的Mucor circinelloides ZG- 3及嗜热真菌中的蓝状菌属Talaromyces flavus S1.酵母菌具有丰富的胞外酶系, 具有脂肪酶、蛋白酶、氧化酶和过氧化物酶等, 具有潜在降解污泥EPS中蛋白质和多糖的能力, 因此在理论上可以提升污泥的脱水性能.此外, 酵母菌为兼性菌, 更能适应现有的A2/O废水处理工艺, 事实上酵母菌在实际废水处理系统中有一定比例的存在(因系统而异).本研究分析了酵母菌对于EPS组分的降解能力, 并探讨了通过向活性污泥中接种一定浓度的酵母细胞来提升剩余污泥的脱水性能的可行性.
1 材料与方法
1.1 实验材料
污泥取自宁波市某采用A2/O工艺污水处理厂的回流污泥.污泥取回后静置30 min, 倒去上清液并使用孔径1.2 mm的筛子过筛.静置后污泥的性质为:污泥沉降比(SV30)为89~91, 混合液悬浮性固体(MLSS)为10.5~13.5 g ·L-1, 挥发性悬浮性固体(MLVSS)为6.0~6.2 g ·L-1, pH值为6.5~7.0, 毛细吸水时间(CST)为20~22 s.
1.2 实验方法
1.2.1 酵母菌菌株、活化及培养
复合酵母菌群为实验室筛选并保藏的3株假丝酵母属菌株, 分别为:Candida tropicalis(O2)、Candida lipolytica(G1)和Candida halophila(W1).将3株酵母菌从斜面分别接种于盛有灭菌(115℃, 20 min)YPD培养液的三角瓶中, 并置于摇床上培养(175 r ·min-1, 28℃)24 h, 之后将3瓶菌悬液等体积混合后接入灭菌的YPD培养液中进行扩大培养.
1.2.2 酵母菌细胞计数及接种量
将扩大培养获得的酵母菌悬液在8 000 g下离心5 min(Thermo Fisher Multifuge X1R, 美国).酵母细胞用0.9%无菌生理盐水洗涤、离心3次后, 将湿菌体重悬于生理盐水中用血球计数法测量酵母细胞浓度, 每次实验将菌悬液稀释至2.0×109个·mL-1待用.
1.2.3 活性污泥EPS的提取
将污泥样品装入100 mL离心管中, 用超声破碎仪(上超FS- 600N, 中国)在20 kHz, 480 W下冰浴超声10 min(经过实验, 在此条件下超声强度不足以使细胞膜破裂, 细胞内容物不会流出), 然后分装至50 mL离心管在12 000 g, 4℃下离心10 min, 上清液即为EPS.
1.2.4 污泥样品及EPS的显微镜观察
取污泥0.5~1.5 mL于无菌离心管中, 在8 000 g下离心5 min, 然后重悬于2.5%戊二醛溶液中在4℃下放置2 h.倒掉固定液, 用1 mol ·L-1, pH=7.0的磷酸缓冲液漂洗样品3次, 每次的漂洗时间为15 min.对样品进行乙醇梯度脱水处理, 然后用100%乙醇处理2次, 并于-80℃冷冻干燥(ALPHR1- 2LD, 德国).使用扫描电子显微镜(Quanta 250FEG, 美国)观察样品.酵母降解EPS实验中, 取三角瓶中的混合液制成水浸片, 在微分干涉显微镜(Nikon 80i, 日本)中直接观察.
1.2.5 分析方法
污泥脱水性采用毛细吸水时间(CST)来表征, 使用CST测定仪(Triton Electronics 304M, 英国)测定;多糖含量的测定采用苯酚-硫酸法, 葡萄糖作为标准物质;蛋白质含量的测定采用Bradford法, 牛血清蛋白作为标准物质;核酸含量的测定采用二苯胺比色法, 小牛胸腺DNA作为标准物质.
三维荧光分析(3D-EEM):用无臭氧氙弧灯作为激发光源, 激发波长Ex的范围是220~450 nm, 发射波长Em的范围是260~600 nm.仪器的激发和发射狭缝宽度设定在5 nm, 光栅时间为0.1 s, 扫描速度为3 200 nm ·min-1, 使用Origin 8. 6软件进行数据处理.
1.3 实验设计
1.3.1 酵母降解EPS实验
在6个150 mL的三角瓶中各加入提取的EPS溶液(pH 6.8)100 mL, 在115℃下灭菌20 min.灭菌后置于超净台中冷却至室温, 向其中3个加入湿菌体0.5 g, 为酵母组;另外3个不添加酵母菌作为对照组, 将三角瓶放置在摇床上175 r ·min-1, 28℃下振荡.分别在0、24、48和72 h时取混合液测定pH值.为了排除酵母菌细胞对EPS组分分析的影响, 将取出的混合液在12 000 g下离心10 min(Eppendorf Centrifuge 5415R, 德国), 测定上清液中蛋白、多糖、核酸含量;同时使用荧光分光光度计(日立F- 4600, 日本)对活性污泥中的荧光物质组分进行分析.
1.3.2 酵母菌提升污泥的脱水性实验
在6个直径为15 cm的有机玻璃反应器中分别装入混合均匀的2 L污泥, 调节pH为6.8, 向3个罐子中分别加入1.5 g酵母菌湿菌体作为酵母组, 另外3罐不加酵母菌作为对照组.使用电磁振动式空气泵通过砂芯曝气头进行曝气, 控制溶解氧(DO)为7 mg ·L-1左右, 温度为28℃.分别于0、24、48和72 h时取污泥样, 测定pH值和CST.分别提取6个罐子中污泥的EPS, 测定蛋白、多糖和核酸组分含量.取出1 mL提取的EPS稀释15倍进行荧光物质分析.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
2 结果与讨论
2.1 酵母菌对EPS不同组分的降解
图 1反映了72 h内三角瓶中EPS组分含量的变化.从图 1(a)可以看出, 接种酵母菌的三角瓶中蛋白质含量在24 h内从81.58 mg ·L-1下降到35.73 mg ·L-1, 降解率达到了56.20%;而对照组则从81.68 mg ·L-1下降到63.03 mg ·L-1, 降解率仅为22.83%, 说明酵母菌在最初的24 h对EPS中蛋白组分有较快速的降解作用;相比之下, 24 h之后, 蛋白质的降解速度趋于平缓.从图 1(b)可以看出, 酵母组中多糖含量在逐步降低, 说明在此过程中酵母菌对多糖有一个持续降解过程, 也表明酵母菌能够利用多糖作为其生长的碳源.值得一提的是, 对照组的多糖含量在24~48 h没有下降反而有了略微的上升.为了探究对照组蛋白质和多糖含量变化的原因, 本研究对对照组中EPS溶液进行了显微镜观察, 发现有许多游离细菌存在, 这说明在115℃下灭菌20 min并未能彻底灭活EPS中的细菌, 其原因是EPS可以维持微生物细胞的生物膜稳定性从而对细胞具有保护作用.这些游离细菌有些可以利用(降解)EPS中蛋白质或多糖而生长, 不能利用的细菌因摇瓶EPS中的营养成分缺乏而死亡解体, 从而溶出蛋白、多糖等细胞内容物质.可能因为游离细菌对蛋白和多糖降解能力差异, 造成了降解量和溶出量相对值的不同, 因而出现了蛋白含量降低而后期多糖含量稍有上升的现象. 图 1(c)为酵母组中核酸含量的变化, 在48 h内核酸从122.50 μg ·L-1大幅度下降至63.33 μg ·L-1, 而对照组中的核酸含量却有略微地上升, 说明在48 h内酵母菌能显著降解核酸组分, 但是在48 h后三角瓶中核酸含量有所上升, 可能是长时间振荡培养导致了营养物质缺乏或者限制, 造成部分酵母细胞死亡释放出了核酸物质.从图 1(a)~1(c)中都可以看出酵母菌可以使EPS各组分的含量降低, 但是各组分变化规律不尽相同, 这应该归因于各组分在污泥EPS中的分布模式不同以及酵母菌对各组分的利用机制的差异.从图 1(d)可以看出在24 h内, 酵母组的总EPS含量比对照组下降趋势更为明显, 表明酵母菌在提高污泥脱水性方面具有一定的潜力. 24~48 h, 酵母组和对照组的总EPS的含量趋于稳定;48 h后酵母组的总EPS有一个下降过程, 而对照组基本趋于稳定.
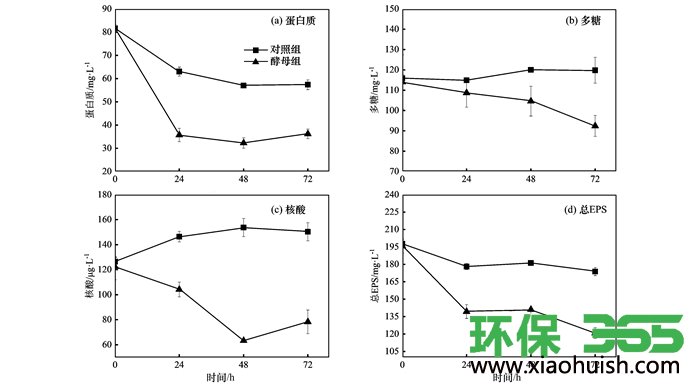
图 1 酵母菌对EPS不同组分及总EPS的降解效果
2.2 酵母菌对EPS中荧光组分的降解
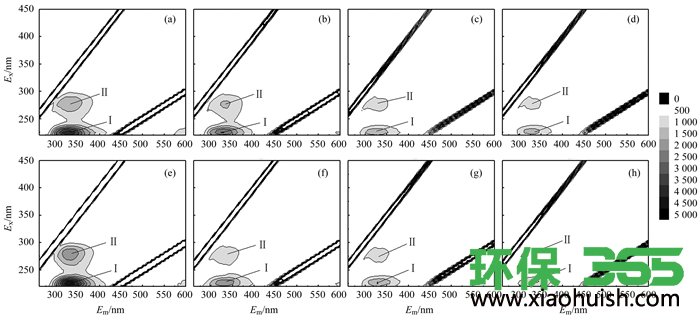
为了更进一步探明酵母菌降解EPS中蛋白质的大致分类, 采用3D-EEM方法对酵母菌降解EPS过程中的荧光物质信号变化进行了跟踪分析. 图 2中的三维荧光图谱可定义为Ⅰ和Ⅱ两种峰.其中, Ⅰ峰的中心位置约为Ex/Em=220~225 nm/330~340 nm, 属于芳香蛋白区域, 是低激发波长类色氨酸;Ⅱ峰的中心位置约为275~280 nm/305~350 nm, 属于可溶性微生物副产物区域, 是高激发波长类色氨酸. 图 2结果显示, 在24 h内, 对照组EPS的Ⅰ峰荧光强度从3 712下降到3 363, 下降率为9.40%;Ⅱ峰的荧光强度从1 589下降到1 407, 下降率为11.45%;酵母组Ⅰ峰的荧光强度从3 716下降到3 354, 下降率为9.74%, Ⅱ峰的荧光强度从1 529下降到1 294, 下降率为15.37%.由此可以看出, 酵母组的蛋白含量在24 h内比对照组下降更多, 尤其是对Ⅱ峰表示的可溶性微生物副产物有更好地降解效果;因此可以判定, 酵母菌对于活性污泥中的可溶性微生物产物有较好地降解作用, 而这部分物质与污泥的脱水性能关系密切.在24~48 h内, 对照组Ⅰ峰的荧光强度从3 363下降到3 128, Ⅱ峰的荧光强度从1 407下降到1 353, 下降率分别为6.99%和3.84%;酵母组Ⅰ峰的荧光强度从3 354下降到2 844, Ⅱ峰的荧光强度从1 294下降到1 117, 下降率分别为15.21%和13.68%, 可以看出在这段时间内, 酵母菌能继续降解EPS组分中的蛋白质;在48 h至72 h内, 对照组Ⅰ峰的荧光强度和Ⅱ峰的荧光强度没有太大的变化, 与化学分析测定的结果相比, 荧光强度下降趋势一致但下降率偏低, 这是因为荧光分析只能表征一些种类的蛋白, 但化学分析测定测得的是总蛋白含量;酵母组Ⅰ峰的荧光强度有略微上升但幅度很小, Ⅱ峰的荧光强则没有太大的变化.

(a)~(d)和(e)~(h)分别为对照组和酵母组在0、24、48和72 h的EPS组分荧光
图 2 酵母菌对EPS中荧光组分的降解效果
2.3 酵母菌降解EPS组分的作用机制
图 3是向EPS中加入酵母细胞培养后观察到EPS絮体的微分干涉照片.可以看出, 酵母菌细胞(较大的圆形或者卵圆形细胞)可以与EPS中的胶状物有效结合, 形成了明显的絮状物, 类似于活性污泥的菌胶团结构.有研究表明, EPS可以维持微生物细胞的生物膜稳定性, 是细菌之间相互黏附的重要介质.本研究中絮状物的形成可能与酵母菌细胞表面性质有关.前期研究中表明, 酵母O2和G1细胞表面具有较强的疏水性, 可以与油脂等疏水性污染物结合, 从而有利于胞外酶对污染物基质的降解以及对代谢产物的吸收. EPS的主要组分是蛋白质和多糖, 其中蛋白质部分具有明显的疏水性基团, 酵母细胞可能与这些疏水性基团相黏附, 形成絮体并将附着的此类物质降解, 代谢产生的小分子物质可以为酵母细胞提供碳源、氮源等营养.有研究表明, 在不外加营养物质的情况下, EPS可以作为支持某些微生物生命活动的碳源和氮源.本研究中, 酵母菌与EPS胶状物体结合在一起, 一方面有利于酵母细胞对EPS的降解, 另一方面可以减少游离水中单细胞酵母的数量, 两者对于提高污泥的脱水性都是有利因素.
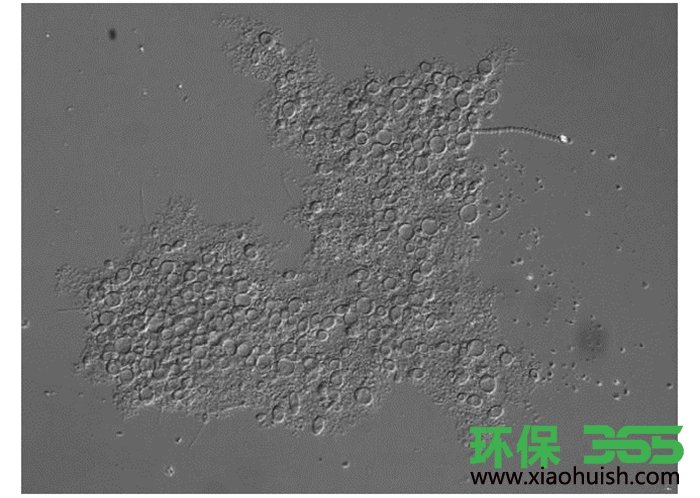
图 3 酵母菌与EPS组分形成的絮状物质的显微图片(10×40)
2.4 酵母菌对提高污泥脱水性的作用
将一定量的酵母菌加入剩余污泥中进行曝气, 评价了酵母菌对于污泥脱水性的提升作用.提取不同曝气时间下的污泥的EPS并对其组分进行分析发现, 在24 h内, 投加酵母菌的反应器中, 蛋白质和多糖的含量下降率分别是(76.73±1.66)%和(44.80±3.68)%;而对照组的罐子中蛋白质和多糖含量下降了(67.02±3.09)%和(23.67±0.92)%.相比较可以看出, 酵母菌的添加对于EPS组分中的多糖有明显的降解作用.有研究表明, 酵母Pseudozyma brasiliensis能通过分泌木聚糖酶从而降解植物多糖;1株土著酵母Saccharomyces cerevisiae依靠PGU1单基因编码的多聚半乳糖醛酸内切酶来降解可可浆中的果胶类多糖.从图 4(c)可以看出, 酵母组和对照组的EPS中核酸含量都有所下降, 酵母组比对照组略高;鉴于核酸在总EPS中的占比很低, 因此核酸含量不是影响污泥脱水性的主因.从图 4(d)中可以看出, 在24 h内, 酵母组中总EPS下降程度比对照组大, 且在24 h时EPS的总量更低, 相应地酵母处理后的污泥CST下降了(17.19±1.16)%, 比对照组多下降了(7.03±1.35)%.但是在24 h之后, 接种酵母的污泥中EPS的多糖和蛋白有略微上升, 这可能与酵母菌自身代谢产物的积累有关, 酵母菌在降解污泥EPS中的多糖后, 经过一定时间培养后自身也会合成多糖排到细胞外.因此, 对于利用添加酵母来提升污泥脱水性能可能存在一个合理的处理时间问题.曝气时间超过24 h, 酵母组和对照组的CST值都出现了上升, 但是在酵母组中总EPS高于对照组的情况下, 酵母组的CST会更低一些, 可能与酵母细胞参与污泥絮体的构建有关.继续曝气至48 h后, 两组污泥的CST持续上升, 对照组的CST达到23.15 s, 高于采集污泥的原始值;酵母组污泥CST值上升至22.1 s, 与采集污泥的原始值接近.
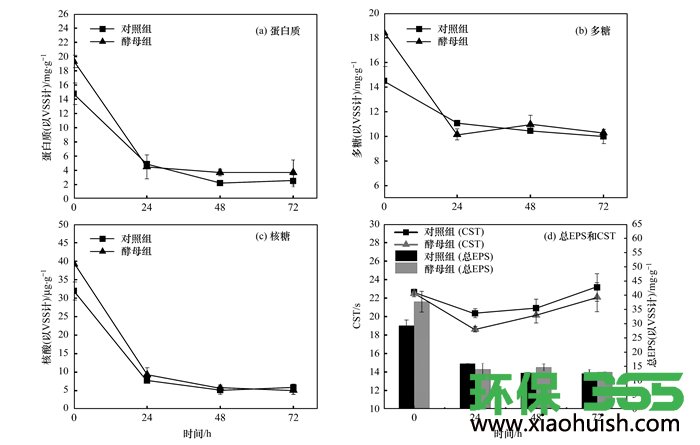
图 4 添加酵母并曝气不同时间后污泥中EPS组分和CST的变化
从图 4(d)可以看出EPS的含量在一定的范围内对污泥的脱水性有一定的影响, EPS含量太高会降低污泥脱水性, 有研究报道当活性污泥的微生物胞外聚合物的含量(以ECP/SS计)为35 mg ·g-1(其中ECP为胞外多聚物)时脱水性能最好. EPS在污泥絮状物结构的稳定性中起重要作用, EPS含量增加, 活性污泥的剪切敏感度降低, 污泥分散度也会降低, 这表明不是EPS含量越低, 污泥脱水性就越好.本研究结果表明, 酵母菌能在24 h内有效降低污泥EPS中的蛋白质和多糖含量, 同时也能降低活性污泥的CST值, 从而有效提高活性污泥的脱水性.从运行的经济性和效果两方面来考虑, 24 h应该是酵母提升污泥脱水性的理想处理时间.
2.5 酵母菌对活性污泥中EPS的荧光组分的原位降解
对不同处理时间后酵母组和对照组反应器中污泥的EPS进行三维荧光分析, 谱图见图 5.从中可以看出0~24 h, 对照组Ⅰ峰的荧光强度从3 785下降到2 577, Ⅱ峰的荧光强度从1 409下降至1 070, 下降率分别为31.92%和24.06%;酵母组Ⅰ峰的荧光强度从4 655下降到1 958, Ⅱ峰的荧光强度从1 924下降到812, 下降率分别为57.94%和57.80%.从结果可以看出, 相较于对照组, 酵母组污泥中EPS的蛋白含量下降更多, 降解速率更快, 且Ⅱ峰表征的可溶性微生物副产物降解率是对照组的2.4倍;Ⅰ峰表征的芳香族蛋白的降解率是对照组的1.8倍.但在24 h后酵母组对蛋白的降解速率相对下降, 如24~48 h, 对照组Ⅰ峰的荧光强度从2 577下降到1 409, Ⅱ峰的荧光强度从1 070下降到729, 下降率分别为45.32%和31.87%;酵母组Ⅰ峰的荧光强度从1 958下降到1 534, Ⅱ峰的荧光强度从812下降到了695, 下降率分别为21.65%和14.41%.但直到72 h时, 酵母组对Ⅰ峰和Ⅱ峰表征物质的总降解率仍然高于对照组, 分别高出了9.22%和16.43%.
(a)~(d)和(e)~(h)分别为对照组和酵母组在0、24、48和72 h的EPS组分荧光
图 5 酵母菌对污泥中EPS荧光组分的降解
2.6 酵母菌提升污泥脱水性的机制
从图 6(a)和6(b)可以清晰地看到酵母菌在活性污泥中的细胞形态特征, 它们处于活性污泥絮体之中, 与污泥的菌胶团结合在一起, 这使得污泥颗粒变大, 更容易沉降和脱水.从图 6(b)可以看到酵母细胞具有明显的芽痕, 说明酵母细胞在处理污泥过程中可能有出芽生殖现象, 印证了酵母细胞在系统中具有生物活性, 为连续处理污泥提供了基础. 图 6(c)是通过微分干涉显微镜对酵母菌在处理活性污泥中的形态进行观察, 从中也可以明显看到酵母菌与活性污泥中的胶状物(EPS)结合在一起, 与在三角瓶实验中观察到的结果相吻合.综上, 酵母菌可以紧密结合污泥中EPS并将其作为营养物质而消耗, 这使得污泥EPS的含量得到了有效地降低, 可以在一定程度上降低剩余污泥的CST值, 从而提升活性污泥的脱水性.从上述实验结果可以看出, 酵母菌对污泥的原位降解率低于摇瓶实验, 这是由于实际污泥的生物系统十分复杂, 大量微生物的存在会影响酵母菌的生存繁殖.此外, 环境因素也会影响到酵母菌对污泥EPS的降解.因此, 后续研究需要通过优化相应条件来提高酵母菌对污泥EPS的降解效率, 如pH、碳源、氮源及影响酵母细胞相关酶活性的微量元素等.

(a)和(b)为扫描电镜; (c)为微分干涉
图 6 酵母菌在活性污泥絮体中的存在形态
2.6 酵母菌提升污泥脱水性的机制
从图 6(a)和6(b)可以清晰地看到酵母菌在活性污泥中的细胞形态特征, 它们处于活性污泥絮体之中, 与污泥的菌胶团结合在一起, 这使得污泥颗粒变大, 更容易沉降和脱水.从图 6(b)可以看到酵母细胞具有明显的芽痕, 说明酵母细胞在处理污泥过程中可能有出芽生殖现象, 印证了酵母细胞在系统中具有生物活性, 为连续处理污泥提供了基础. 图 6(c)是通过微分干涉显微镜对酵母菌在处理活性污泥中的形态进行观察, 从中也可以明显看到酵母菌与活性污泥中的胶状物(EPS)结合在一起, 与在三角瓶实验中观察到的结果相吻合.综上, 酵母菌可以紧密结合污泥中EPS并将其作为营养物质而消耗, 这使得污泥EPS的含量得到了有效地降低, 可以在一定程度上降低剩余污泥的CST值, 从而提升活性污泥的脱水性.从上述实验结果可以看出, 酵母菌对污泥的原位降解率低于摇瓶实验, 这是由于实际污泥的生物系统十分复杂, 大量微生物的存在会影响酵母菌的生存繁殖.此外, 环境因素也会影响到酵母菌对污泥EPS的降解.因此, 后续研究需要通过优化相应条件来提高酵母菌对污泥EPS的降解效率, 如pH、碳源、氮源及影响酵母细胞相关酶活性的微量元素等.(来源:宁波大学土木与环境工程学院 作者:俞心怡)
销毁处理中心进行资源整合的平台下独资与合资环保企业共15余家,联盟机构和环保公司13家,是本地区业务范围最全、回收管理服务范围最广、经营资质最齐全的综合管理服务平台。有环保工程师和专业回收人员350余名,他们在业务开展中所持的资质有:A.企业法人营业执照 B.上海市、北京市、广州市、四川成都市等市危险废物经营许可证 C.生产性废旧金属收购许可证 D.ISO14000环境管理体系 E.OHSAS18000职业健康和安全管理体系F.环境污染治理设施运营许可证等资质。
上海奉贤废水处理厂家是什么?
上海奉贤365污水污泥处理公司 : 主要是为了配合国家环保相关部和工业、安全生产、海关、工业信息化、质量管理、安检、工商等部门针对缺陷产品及不合格产品、过期产品、假冒伪劣产品、质量问题、变质产品、产品销毁处理能得到规范、安全环保处置提供一站式产品报废销毁处理服务,以促进“节能减排、无害化处置、循环经济、绿色生产”的理念,保护消费者合法权益,维护企业市场品牌荣誉。主要业务:污水处理 污泥处理、生活污水处理、污泥回收、污泥处置、城市污水处理、污水污泥处理、污泥干燥、废水处理、活性污泥处理、污泥处理工艺、活性污泥处理、含油污泥处理、工业污泥处理、工业污水处理、城市污泥处理、农村污水处理、食品污水处理等服务。